TÓM TẮT
Thí nghiệm được tiến hành với mục đích tìm hiểu diễn biến quá trình ủ chất thải chăn nuôi gà và hiệu quả tiêu diệt mầm bệnh, là bước đầu trong mục tiêu xây dựng mô hình xử lý chất thải cho các trại chăn nuôi gia cầm quy mô vừa và nhỏ, sử dụng phân ủ làm phân bón nông nghiệp. Chất thải (lót chuồng) được thu thập từ 2 trại chăn nuôi gà thịt. Chất thải của mỗi trại được phân thành 8 lô thí nghiệm: Lô 1 là phân nguyên liệu, trong suốt quá trình ủ không trộn phân; Lô 2, 4, 6 và 8 được trộn thêm sản phẩm vi sinh EM; Lô 5, 6, 7 và 8 được trộn thêm trấu; Lô 3, 4, 7 và 8 được đảo trộn mỗi tuần. Chất thải nguyên liệu được kiểm tra hàm lượng C và N. Số lượng một số nhóm vi sinh vật và sự hiện điện của Salmonella trong chất thải nguyên liệu và trong mẫu phân của các lô được kiểm tra. Kết quả thí nghiệm cho thấy sau 2-3 ngày ủ, nhiệt độ các đống phân tăng cao >50°C và vẫn duy trì ở trong khoảng 55-65°C cho tới 21 ngày. Nhờ vậy, số lượng các vi khuẩn đường ruột giảm đáng kể.
Phân sau khi ủ 21 ngày không phát hiện được vi khuẩn gây bệnh Salmonella trong tất cả các mẫu ủ, nhiều mẫu ủ cũng không tìm thấy E. coli. Việc bổ sung thêm trấu và trộn đống phân ủ mỗi tuần làm tăng quá trình phân huỷ sinh học chất thải, làm giảm và mất mùi hôi của phân nhanh chóng. Việc bổ sung EM vào chất thải không cho thấy hiệu quả đáng kể lên quá trình sinh nhiệt và diệt khuẩn, nếu không kết hợp với bổ sung trấu và trộn đống phân.
Từ khóa: Composting, gia cầm, ủ phân hiếu khí, phân bón hữu cơ.
ABSTRACT
Composting poultry manure
The experiment was conducted to study the process of poultry manure composting and its effect
on killing pathogens. This was a first step in the aim to develop a model of manure management for small and medium-scaled poultry farms and use of the compost as biofertilizers. Manure/litter was collected from 2 broiler farms. The materials from each farm were divided into 8 different treatments. Treatment 1 included raw manure and stayed unturned during 21-day composting.
An EM product was mixed with the materials in Treatment 2, 4, 6 and 8; and rice husks were added in Treatment 5, 6, 7 and 8. Composting piles in Treatment 3, 4, 7 and 8 were weakly turned.
The results showed that after 2 to 3 days of incubation, the temperature of the piles increased to >50°C and remained at 50-65°C until day 21. The number of manure bacteria remarkably decreased. Salmonella was not detected from all 21-day compost samples, neither did E. coli in samples of several treatments. The addition of rice husks and weekly mixing compost piles helped to increase the biodegradation of manure and quickly reduce manure odor. The addition of EM, without combination with rice husks and turning the pile, did not seem to produce a significant effect on the heat generation and microbial.
Keywords: Biofertilizer, composting, manure, poultry.
1. ĐẶT VẤN ĐỀ

Theo Bộ Nông nghiệp và Phát triển nông thôn, năm 2019 Việt Nam có đàn gia cầm phát triển tốt: sản lượng đạt 1,3 triệu tấn, tăng 15% so với năm 2018; thịt gia cầm hơi ước đạt 1.278,6 nghìn tấn, tăng 16,5% và sản lượng trứng đạt 13,3 tỷ quả, tăng 14%. Cùng với sự phát triển kinh tế, chăn nuôi gia cầm cũng làm tăng áp lực giải quyết ô nhiễm môi trường từ chất thải chăn nuôi.
Phân gia cầm là môt nguồn phân bón hữu cơ nông nghiệp truyền thống trên thế giới. Ngoài việc chứa hàm lượng cao các khoáng đa lượng N, P, K, phân gia cầm còn chứa calcium, magnesium, sulfur và các vi khoáng (Zhang và ctv, 2017). Ở Việt Nam, phân gia cầm được sử dụng phổ biến làm phân bón rau màu và cây ăn quả (Tran Thi Dan và ctv, 2004; Nguyễn Trung Thịnh và ctv, 2019). Tuy nhiên, khi phân chưa được xử lý hợp lý trước khi bón cây, việc dùng phân gà/cút bón cây vẫn còn nhiều nhược điểm, bị ô nhiễm không khí do mùi hôi, ô nhiễm chất hữu cơ cho đất và các nguồn nước. Ngoài ra, phân gia cầm có chứa vi sinh vật và ký sinh trùng, trong đó có nhiềm mầm bệnh cho gia cầm và người. Ủ phân hiếu khí (composting) là cách xử lý phân rất hiệu quả.
Trong quá trình này, các vi sinh vật – đặc biệt là vi khuẩn và nấm, chuyển các chất hữu cơ trong phân thành các chất dễ hấp thu cho cây trồng, được dùng rất phổ biến để lót đất (soil conditioning) cũng như là nguồn phân bón sinh học (biofertilizer) quý giá. Phân sau khi ủkhông còn mùi hôi và có số lượng mầm bệnh giảm đáng kể (Parr và ctv, 1994).
Đề tài này được tiến hành với mục đích tìm hiểu diễn biến quá trình ủ chất thải chăn nuôi gà và hiệu quả tiêu diệt mầm bệnh để tối ưu hoá quy trình ủ chất thải gia cầm - dễ áp dụng và hiệu quả, làm mô hình xử lý chất thải cho các trại chăn nuôi quy mô vừa và nhỏ.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Bố trí thí nghiệm
Thí nghiệm (TN) được lặp lại 2 lần: Lần 1, nguyên liệu ủ là chất thải chuồng gà (hay còn gọi là phân) được thu gom từ một trại chăn nuôi gà ở TP Hồ Chí Minh, có thành phần gồm khoảng 85% phân gà, 10% trấu và5% mùn cưa; Lần 2, chất thải chuồng gà được thu gom từ một trại chăn nuôi gà ở Đồng Nai có thành phần gồm khoảng 85% phân gà và 15% trấu.
Trước khi phân lô TN, mẫu chất thải được thu để phân tích các chỉ tiêu C và N, một số chỉ tiêu vi sinh vật. Chất thải được phân thành các khối ủ (lô), mỗi khối khoảng 100kg, có kích thước 1,2x0,7x0,5m. Các lô ủ được phủ bạt (bằng nhựa) và được bố trí cách nhau khoảng 1m.
Thí nghiệm được chia thành nhiều lô để khảo sát tác dụng lên quá trình ủ phân của 3 yếu tố: 1) Bổ sung vi sinh vật hữu hiệu (EM, effective microorganisms); 2) Bổ sung 5kg trấu vào một số lô để tăng tỷ lệ C cho phân và tăng mức độ xốp thoáng của đống phân; 3) Đảo trộn đống phân. Mỗi đợt TN, chất thải được chia thành 8 lô ủ như sau:
Lô 1: Không đảo trộn (đối chứng).
Lô 2: Bổ sung EM, không đảo trộn.
Lô 3: Được đảo trộn.
Lô 4: Bổ sung EM, được đảo trộn.
Lô 5: Bổ sung trấu.
Lô 6: Bổ sung trấu và EM.
Lô 7: Bổ sung trấu, được đảo trộn.
Lô 8: Bổ sung trấu, EM, được đảo trộn. Sản phẩm EM1 (EMRO, Việt Nam) được pha theo hướng dẫn của nhà sản xuất và được ủ với rỉ mật đường và nước (1:1:18) trong 5-7ngày. 25l dịch ủ này được trộn cho 100kg chất thải để ủ.
* Kiểm tra các tính chất vật lý của đống ủ
Nhiệt độ và độ ẩm tương đối (RH) của mỗi lô ủ được đo hàng ngày vào 8 và 16 giờ. Mỗi lần đo, dụng cụ đo được cắm sâu khoảng 15cm (từ bề mặt đống ủ), lần lượt tại 5 vị trí khác nhau của mỗi đống ủ, sau đó số liệu được tính trung bình cho 1 lần đo. Nhiệt độ của đống ủ hàng ngày là số trung bình của 2 lần đo trong ngày.
* Kiểm tra hàm lượng C và N
Các chỉ tiêu C và N của chất thải trước khi phân lô TN được kiểm tra. Mẫu được gửi kiểm tra ở Trung tâm Công nghệ và Quản lý Môi trường và Tài nguyên, Đại học Nông Lâm TPHCM. Hàm lượng C của mẫu được phân tích theo TCVN 8557:2010 và N theo TCVN 9294:2012. * Kiểm tra các chỉ tiêu vi sinh vật của lô ủ
Trước và sau khi kết thúc ủ, mẫu phân được thu thập để kiểm tra các chỉ tiêu vi sinh vật và trứng ký sinh trùng. Mẫu để kiểm tra số lượng các vi khuẩn và nấm được pha loãng bằng cách lấy 25g mẫu cho vào 225ml nước muối sinh lý và pha loãng thập phân trong nước muối sinh lý.
Tổng số vi khuẩn hiếu khí (TSVKHK) được kiểm tra bằng phương pháp trải mẫu (plate counting). Mẫu ở các độ pha loãng liên tiếp được cấy trải lên các đĩa thạch PCA (plate count agar, Merk, 1.05463.0500). Mỗi mẫu được cấy lặp lại hai lần. Sau khi ủ ở 37oC trong 24 giờ, số lượng khuẩn lạc ở các đĩa có 30-300 khuẩn lạc được đếm.
Coliforms của mẫu được đếm bằng phương pháp pha loãng tới hạn - MPN (most probable number). Mẫu pha loãng được cấy trong các ống canh lauryl tryptose broth (HiMedia, M080) và có chứa ống durham, ủ ở 37oC/24 giờ. Các ống canh LTB có vi khuẩn mọcvà sinh hơi được cấy chuyển sang ống canh brilliant green bile broth (Merck, 1.05454.0500) có chứa ống durham, ủ ở 37oC/24 giờ. Quy trình kiểm tra và đọc kết quả theo hướng dẫn TCVN 6404-2008.
Vi Khuẩn E. coli được kiểm tra bằng cách trải 0,1ml mỗi mẫu pha loãng lên đĩa thạch eosin methylene blue (Merck, 1.01347.0500), ủ ở 37oC/24 giờ. Các khuẩn khuẩn lạc có màu tím đen và có ánh kim được đếm. Hai khuẩn lạc màu tím ánh kim từ mỗi đĩa được kiểm tra với các phản ứng IMViC (indole, methyl res, Voges Proskauer, citrate) để xác định E. coli.
Sự hiện diện của vi khuẩn Salmonella trong mẫu được kiểm tra theo TCVN 7185- 2002. Cho 25g mẫu được cho vào 225ml canh peptone đệm và ủ ở 37oC/24 giờ. Sau đó, 1ml mẫu tăng sinh được cấy chuyển vào canh Rappaport (Oxoid, CM0669), ủ ở 43oC/24 giờ; và canh Tetrathionate (Oxoid, CM0029), ủ ở 37oC/24 giờ. Sau đó, mỗi canh khuẩn được cấy chuyển sang môi trường xylose lysine deoxycholate (X.L.D., Oxoid, CM0469), ủ ở 37oC/24 giờ. Từ mỗi đĩa X.L.D., hai khuẩn lạc có màu hồng và tâm đen được cấy kiểm tra với môi trường TSI (triple sugar iron, Merck, 1.03915.0500) và IMViC. Cuối cùng các gốc vi khuẩn nghi ngờ là Salmonella được xác định bằng phản ứng ngưng kết nhanh trên phiến kính với huyết thanh đa giá Salmonella của Viện Pasteur TPHCM.
Tổng số nấm mốc và nấm men được kiểm tra bằng cách cấy trải 0,1ml mỗi mẫu pha loãng lên thạch sabouraud dextrose agar (Oxoid, CM0041), ủ ở 30oC/2-3 ngày. Tất cả các kiểm tra định lượng vi sinh vật đều được lặp lại 2 lần, kết quả được tính trung bình và trình bày theo đơn vị CFU (colony forming unit) trong 1g.
Trứng ký sinh trùng và cầu trùng được kiểm tra theo phương pháp phù nổi. 2g chất thải được cho vào 10ml nước muối bão hoà, khuấy trộn đều và được lọc qua rây (khoảng 81 lỗ/cm2). Phần nước lọc được cho đầy vào một ống nghiệm, một phiến kính mỏng được đặt lên ống và phải tiếp xúc với mẫu. Mẫu được để yên 30 phút. Phiến kính mỏng được áp lên một tấm kính sạch và được soi dưới kính hiển vi độ phóng đại 400x để tìm trứng ký sinh trùng. Mỗi mẫu được kiểm tra 3 lần (triplicate).
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Chỉ tiêu C/N
Kết quả phân tích 2 mẫu chất thải chuồng gà (chất thải nguyên liệu) trước khi ủ cho tỷ lệ C:N là 16,7 (đợt 1) và 22,7 (đợt 2). Mẫu chất thải được trộn thêm trấu (dùng cho các lô 5, 6, 7 và 8) có tỷ lệ C:N là 30,7 (đợt 1) và 26,8 (đợt 2). Theo Parr và ctv (1994), trong quá trình phân huỷ chất thải hữu cơ, vi sinh vật cần C cho năng lượng và nguyên liệu tổng hợp - tăng sinh khối. Chúng cũng cần N để tổng hợp protein và axít nucleic. Quá trình phân huỷ chất hữu cơ nhanh và hiệu quả cao khi tỷ lệ C:N trong khoảng 15-35. Tỷ lệ này thấp có thể dẫn đến sự giải phóng ammonia ra môi trường, trong khi tỷ lệ C:N quá cao làm giảm tốc độ phân huỷ sinh học.
3.2. Độ ẩm và nhiệt độ của các đống ủ
Độ ẩm tương đối (RH) của mỗi đống ủ được đo hàng ngày vào 8 và 16 giờ. Độ ẩm đống ủ được duy trì trong khoảng 50-60%. Khi RH <50%, nước được phun nhẹ vào để làm tăng độ ẩm của đống ủ. Sự phân huỷ chất thải do vi sinh vật thực hiện, do đó môi trường cần duy trì độ ẩm thích hợp cho vi sinh vật tăng sinh. Tuy nhiên, composting là quá trình phân huỷ do các vi sinh hiếu khí thực hiện. Độ ẩm quá cao làm ô xy khó khuếch tán vào đống ủ, hạn chế hoạt động của các vi sinh vật hiếu khí.
Đồng thời, môi trường thiếu ô xy làm tăng các hoạt động sinh học yếm khí, quá trình phân huỷ xẩy ra chậm, không sinh nhiệt và sinh ra các chất hữu cơ có mùi hôi (Parr và ctv, 1994).
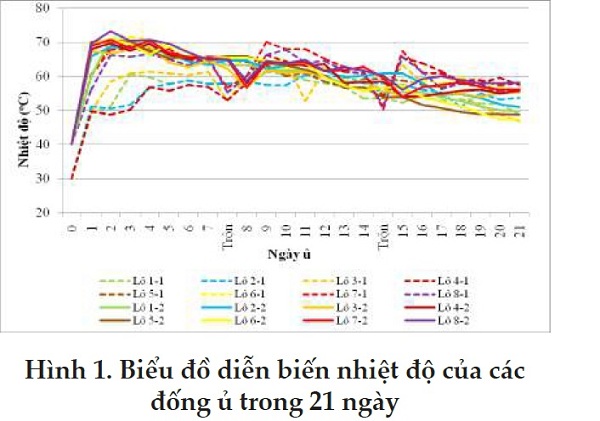
Nhiệt độ của mỗi đống ủ được đo 2 lần mỗi ngày, vào 8 và 16 giờ, được tính trung bình hàng ngày. Kết quả cho thấy nhiệt độ 2 lần đo trong một ngày không biến động cao, CV% <12,4% (đợt 1) và <9% (đợt 2). Sau khi ủ 1 ngày, nhiệt độ các đống ủ bắt đầu tăng. Từ ngày thứ 3, nhiệt độ các đống ủ tăng lên đến 50˚C và có lúc lên tới gần 70˚C và được duy trì cho tới ngày 21 (Hình 1). Theo Parr và ctv (1994), quá trình phân huỷ chất thải hữu cơ hiếu khí (composting) do hỗn hợp nhiều nhóm vi sinh vật hiếu khí – vi khuẩn, actinomycetes và nấm thực hiện, đặc biệt là các vi khuẩn ưa nhiệt (thermophile). Vì vậy, song song với quá trình phân huỷ chất hữu cơ là quá trình sinh nhiệt, làm nhiệt độ đống ủ tăng lên. Nhiệt độ đống ủ nên duy trì trong khoảng 40-65˚C. Nhiệt độ 52-60˚C là tối ưu.
Hoạt động của vi sinh vật bắt đầu giảm khi nhiệt độ đống ủ >63oC (Bernal và ctv, 2009). Nhiệt độ cao 50-60˚C kéo dài trong 2-3 tuần là yếu tố làm giảm số lượng vi sinh vật, đặc biệt là các vi sinh vật gây bệnh trong đống ủ, cũng như phá vỡ trứng ký sinh trùng. Sau 3 tuần, nhiệt độ đống ủ bắt đầu giảm, do nguồn dinh dưỡng cho hệ vi sinh vật
Như đã trình bày, quá trình phân huỷ chất hữu cơ chỉ sinh nhiệt trong điều kiện hiếu khí. Quá trình này bởi các vi sinh vật có sẵn trong phân và các chất trộn vào. Do đó, quá trình bị ảnh hưởng bởi một số yếu tố quan trọng như: độ xốp của đống ủ, ẩm độ của đống ủ, và thành phần vi sinh vật trong đống ủ.
Trong nghiên cứu này, các lô được thiết kế khác nhau để đánh giá tác động của các yếu tố nghiên cứu. Cụ thể: i) sản phẩm EM được trộn vào các lô 2, 4, 6 và 8); ii) các lô 5, 6, 7 và 8 được trộn thêm trấu; iii) các lô 3, 4, 7 và 8 được đảo trộn mỗi tuần. Số liệu trình bày trong Bảng 1 cho thấy số lần đo nhiệt độ ≥55˚C hay ≥60˚C của đống ủ thứ nhất – không thêm EM và trấu, không đảo trộn là ít nhất. Việc bổ sung EM ở lô 2 không có kết quả khác biệt nhiều hơn so với lô 1. Sự trộn đống phân ở lô 3 cho số lần đo nhiệt độ ≥55oC hay ≥60oC nhiều hơn lô 1. Lô 7 và 8 cho số lần đo nhiệt độ ≥55oC hay ≥60oC nhiều nhất là các lô có bổ sung trấu và được trộn hàng tuần.
Theo Parr và ctv (1994), vi sinh vật tham gia quá trình phân huỷ là các vi sinh vật có sẵn trong phân. So sánh nhiệt độ các cặp lô: 1 và 2, 3 và 4, 5 và 6, 7 và 8 (các yếu tố khác giống nhau, chỉ khác nhau về EM), không thấy có sự khác nhau về nhiệt độ (Bảng 1). Trong khi đó, các lô có trộn thêm trấu – tăng hàm lượng C và tăng độ xốp đống phân, cũng như các lô có trộn mỗi tuần, cho số lần đo nhiệt độ ≥55oC hay ≥60oC nhiều hơn các lô còn lại. Điều này khẳng định sự thoáng khí của đống phân ủ là yếu tố quan trọng, tạo điều kiện thuận lợi cho quán trình phân huỷ sinh học hiếu khí xảy ra nhanh hơn (Parr và ctv, 1994; Bernal và ctv, 2009; Zhang và ctv, 2017).
Không phát hiện Salmonella trong tất các các mẫu phân ủ của cả 2 đợt ủ. Không phát hiện vi khuẩn E. coli trong mẫu phân sau 21 ngày của các lô 5, 6, 7, 8 của đợt 1 và phân của của lô 4, 7 và 8 của đợt 2. Số lượng vi khuẩn của các lô có trộn mỗi tuần và có bổ sung EM hay/và trấu (lô 4, 7, 8) có sự giảm số lượng vi khuẩn nhiều hơn các lô còn lại, nhiều nhất là ở lô 8 (có trộn EM và trấu, và có đảo trộn). Nhiệt độ đống ủ ≥55 oC là yếu tố cần thiết để diệt các mầm bệnh trong đống ủ (Bernal và ctv, 2009).
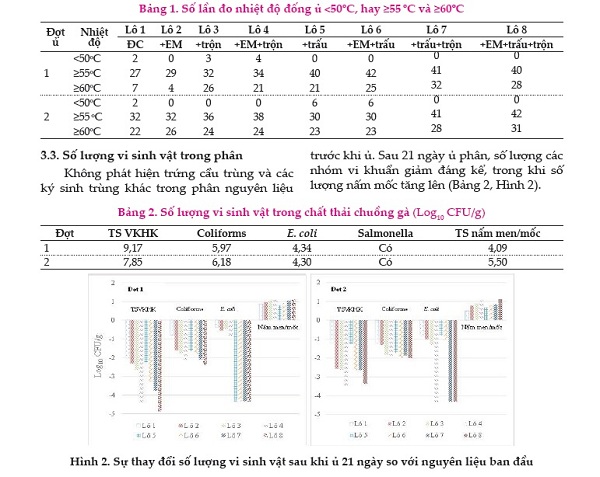
Như đã trình bày ở trên, các lô 7 và 8 (có trấu và có trộn mỗi tuần) duy trì được nhiệt độ cao ≥55oC và ≥60˚C nhiều ngày hơn, do đó kết quả diệt vi khuẩn ở các lô này là cao nhất. Mặc dù việc bổ sung EM vào lô 4 không có khác biệt cao về nhiệt độ đống ủ so với lô 3, nhưng kết quả diệt vi khuẩn ở lô 4 cao hơn rõ rệt (vài Log10 CFU/g). Sự cạnh tranh của các vi khuẩn được bổ sung từ EM có lẽ đã góp phần diệt các vi khuẩn đường ruột trong đống phân.
Ở tất cả các lô sau khi ủ số lượng nấm men và nấm mốc đều tăng so với phân nguyên liệu, khoảng 0,5-1,1Log10 CFU/g. Nấm men và mốc giữ vai trò quan trọng trong suốt quá trình phân huỷ các chất hữu cơ như đường, các axít amin, các protein, và các polymer khác, góp phần làm tăng nhiệt độ đống ủ. Tuy nhiên, nấm bị ức chế khi nhiệt độ ≥60oC (Bernal và ctv, 2009). Trong quá trình phát triển, một số nấm có khả năng tổng hợp các acid hữu cơ như acid citric, axít gluconic, … một số loại khác có khả năng tổng hợp kích thích tố gibberellin và một số loại nấm có thể ký sinh trên côn trùng gây hại qua đó có thể dùng làm thiên địch diệt côn trùng.
Ngoài ra, có những loại nấm sống cộng sinh với thực vật như nấm rễ (Mycorrhizae), giúp cho rễ cây hút được nhiều hơn lượng phân vô cơ khó tan và cung cấp cho nhu cầu phát triển của cây trồng (Nguyễn Văn Bá và ctv, 2005). Do đó, nấm có vai trò quan trọng, tích cực đến quá trình ủ phân và cải thiện môi trường đất.
Trong quá trình ủ phân, sự thay đổi mùi hôi, màu sắc và độ tơi xốp của các đống phân ủ được theo dõi. Trong 1-2 ngày đầu, các đống ủ có mùi hôi thối (phân) như nhau. Mùi hôi từ các đống phân giảm dần trong quá trình ủ. Mùi hôi từ lô 1 duy trì kéo dài trong khoảng 10 ngày đầu. Ở lô 8 (bổ sung EM, trấu và trộn phân mỗi tuần), sau 2-3 ngày, mùi phân giảm hẳn. Ở các lô còn lại, mùi hôi thối của phân hầu như mất đi sau 5-6 ngày ủ. Màu sắc của các đống ủ cũng thay đổi, sậm dần trong quá trình ủ. Sau 21 ngày, các đống ủ không còn mùi phân hôi thối, màu sậm và tơi xốp.
4. KẾT LUẬN
Kết quả TN cho thấy ủ phân hiếu khí có tác dụng làm giảm số lượng các vi khuẩn đường ruột một cách đáng kể. Phân sau khi ủ 21 ngày không phát hiện được vi khuẩn gây bệnh Salmonella trong tất cả các mẫu ủ, nhiều mẫu ủ cũng không tìm thấy E. coli. Như vậy, chất thải chăn nuôi gà ủ hiếu khí có thể sử dụng làm phân bón nông nghiệp an toàn mầm bệnh theo TCVN 7185:2002 đối với phân hữu cơ vi sinh. Bổ sung trấu và trộn đống phân ủ mỗi tuần làm tăng quá trình phân huỷ sinh học chất thải, làm giảm và mất mùi hôi của phân nhanh chóng. Bổ sung EM vào chất thải không cho thấy hiệu quả đáng kể lên quá trình sinh nhiệt và diệt khuẩn, nếu không kết hợp với bổ sung trấu và trộn đống phân.
Hồ Thị Kim Hoa1, Lê Hữu Ngọc 1*, Dương Chánh Tây1, Nguyễn Thị Huệ 1, Vũ Thuận Thành1 và Huỳnh Trung Tín1
Ngày nhận bài báo: 13/01/2021 - Ngày nhận bài phản biện: 20/01/2021
Ngày bài báo được chấp nhận đăng: 05/02/2021
1 Trường Đại học Nông Lâm Thành phố Hồ Chí Minh
* Tác giả liên hệ: Lê Hữu Ngọc, Trường Đại học Nông Lâm TP Hồ Chí Minh; ĐT: 0918764211; Email: lhngoc@hcmuaf.edu.vn
Nguồn: Tạp chí KHKT Chăn nuôi
Địa chỉ: Tầng 4, Tòa nhà 73, Hoàng Cầu, Ô Chợ Dừa, Đống Đa, Hà Nội.
Điện thoại: 024.36290621
Fax: 024.38691511
E - mail: tapchichannuoi@hoichannuoi.vn
TÀI LIỆU THAM KHẢO
1. Nguyễn Văn Bá, Cao Ngọc Điệp và Nguyễn Văn Thành (2005). Giáo trình Nấm học. Đại học Cần Thơ, Ebook. moet.gov.vn, 2008. Trang 10-13.
2. Bernal M.P., Alburquerque J.A. and Moral R. (2009). Composting of animal manures and chemical criteria for compost maturity assessment. A review. Biores. Tech., 100: 5444-53.
3. Tran Thi Dan, Thai Anh Hoa, Le Quang Hung, Bui Minh Tri, Ho Thi Kim Hoa, Le Thanh Hien and Nguyen Ngoc Tri (2004). Project Report: Area-wide Integration (AWI) of specialized crop and livestock activities in Vietnam, funded by LEAD (FAO). http://www.fao.org/wairdoctv/ lead/x6157e/x6157e00.htm.
4. Parr J.F., Hornick S.B. and Kaufman D.D. (1994). Use of Microbial Inoculants and Organic Fertilizers in Agricultural Production. Food and Fertilizer Technology Center for the Asian and Pacific Region. https://www.fftc. org.tw/en/publications/main/782. Tải về 23/1/2021.
5. Nguyễn Trung Thịnh, Thái Quốc Hiếu, Lê Vĩnh Nguyên Hân, Trần Thị Dân, Nguyễn Ngọc Tuân và Hồ Thị Kim Hoa (2019). Sử dụng các chế phẩm vi sinh vật hữu hiệu để hạn chế ô nhiễm môi trường từ chăn nuôi gia cầm. Tạp chí KHKT Thú y, XXVI(5): 63-70.
6. Zhang H., Hamilton P.W. and Payne J. (2017). Using Poultry Litter as Fertilizer. Document # PSS-2246. Division of Agricultural Sciences and Natural Resources, Oklahoma State University